
 5:21
5:21
2024-10-30 20:00

 9:21
9:21

 9:21
9:21
2024-12-05 22:16

 1:37
1:37

 1:37
1:37
2024-01-19 14:26
![САШАТАНЯ, 5 сезон, 1 серия]() 22:06
22:06
 22:06
22:06
2025-06-10 13:54

 52:23
52:23

 52:23
52:23
2025-04-13 18:12

 14:00
14:00

 14:00
14:00
2023-11-29 14:55

 10:27
10:27

 10:27
10:27
2025-07-31 10:11

 7:27
7:27

 7:27
7:27
2025-01-16 03:31
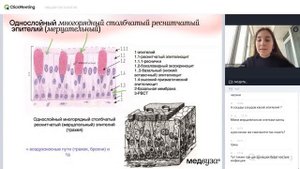
 2:26:46
2:26:46

 2:26:46
2:26:46
2023-11-01 01:09

 6:15
6:15

 6:15
6:15
2023-12-17 02:31

 9:00
9:00

 9:00
9:00
2024-10-23 06:40
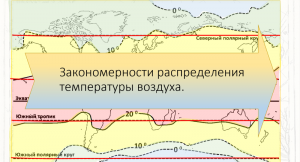
 7:60
7:60

 7:60
7:60
2023-02-02 22:25

 9:15
9:15

 9:15
9:15
2023-09-12 20:59

 8:28
8:28

 8:28
8:28
2023-09-10 01:19
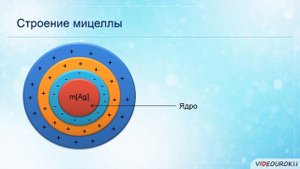
 11:57
11:57

 11:57
11:57
2023-09-09 23:21

 18:23
18:23

 18:23
18:23
2023-01-07 15:58

 8:04
8:04

 8:04
8:04
2024-02-21 10:14

 4:05
4:05
![Taylor Swift - The Fate of Ophelia (Official Video 2025)]() 3:58
3:58
![Анвар Нишонов - Тулкилар (Премьера клипа 2025)]() 3:38
3:38
![Ольга Сокурова, Ислам и Карина Киш – СИ ГУГЪАПlЭ (Премьера клипа 2025)]() 3:20
3:20
![Игорь Кибирев - Пьяная ночь (Премьера клипа 2025)]() 3:08
3:08
![Любовь Попова - Прощай (Премьера клипа 2025)]() 3:44
3:44
![MARSO - Дура (Премьера клипа 2025)]() 3:05
3:05
![Фаррух Хамраев - Отажоним булсайди (Премьера клипа 2025)]() 3:08
3:08
![Фати Царикаева - Стамбул (Премьера клипа 2025)]() 2:57
2:57
![Сардор Хайруллаев - Келма (Премьера клипа 2025)]() 4:10
4:10
![Зафар Эргашов - Мусофирда каридим (Премьера клипа 2025)]() 4:58
4:58
![MIA BOYKA - А он такой (Премьера клипа 2025)]() 2:24
2:24
![Женя Белоусова - Кто тебе сказал (Премьера клипа 2025)]() 3:27
3:27
![Азамат Ражабов - Отам (Премьера клипа 2025)]() 4:38
4:38
![Anette - Erjanik em (Official Video 2025)]() 3:36
3:36
![Lx24 - Сберегу (Премьера клипа 2025)]() 2:57
2:57
![Жалолиддин Ахмадалиев - Тонг отгунча (Премьера клипа 2025)]() 4:44
4:44
![Премьера клипа! Игорь Крутой — Зонтик]() 4:00
4:00
![Ганишер Раззоков - Дилижон (Премьера клипа 2025)]() 3:46
3:46
![M1DNITE - Ghost Touch]() 3:36
3:36
![Динара Швец - Новая история (Премьера клипа 2025)]() 3:45
3:45
![M3GAN 2 | M3GAN 2.0 (2025)]() 2:00:03
2:00:03
![Сверху вниз | Highest 2 Lowest (2025)]() 2:13:21
2:13:21
![Опустошение | Havoc (2025)]() 1:47:26
1:47:26
![Долина эха | Echo Valley (2025)]() 1:44:37
1:44:37
![Бабули | Nonnas (2025)]() 1:54:10
1:54:10
![F1 (2025)]() 2:35:53
2:35:53
![Источник вечной молодости | Fountain of Youth (2025)]() 2:05:22
2:05:22
![Улица Страха: Королева выпускного | Fear Street: Prom Queen (2025)]() 1:30:05
1:30:05
![Стив | Steve (2025)]() 1:33:34
1:33:34
![Только ты | All of You (2025)]() 1:38:22
1:38:22
![Раст | Rust (2024)]() 2:19:54
2:19:54
![Девушка из каюты №10 | The Woman in Cabin 10 (2025)]() 1:35:11
1:35:11
![Путь рыцаря | A Knight's War (2025)]() 1:43:53
1:43:53
![Блиц | Blitz (2024)]() 2:00:30
2:00:30
![Дьявол | Diablo (2025)]() 1:31:20
1:31:20
![Школьный автобус | The Lost Bus (2025)]() 2:09:55
2:09:55
![Соник 3 в кино | Sonic the Hedgehog 3 (2024)]() 1:50:21
1:50:21
![Мир юрского периода Возрождение | Jurassic World: Rebirth (2025)]() 2:13:53
2:13:53
![Заклятие 4: Последний обряд | The Conjuring: Last Rites (2025)]() 2:15:54
2:15:54
![Электрический штат | The Electric State (2025)]() 2:08:34
2:08:34
![ЛЕГО Манки Кид: Рождение героя (2020) / Lego Monkie Kid: A Hero Is Born]()
 45:00
45:00
![Земля до начала времён 10: Великая миграция (2003) / The Land Before Time X]()
 1:24:21
1:24:21
![Плохие парни 2 (2025) / The Bad Guys 2]()
 1:43:47
1:43:47
![Науэль и волшебная книга (2020) / Nauel and the Magic Book]()
 1:37:06
1:37:06
![Альфа и Омега 3: Большие Волчьи Игры (2013) / Alpha and Omega 3: The Great Wolf Games]()
 45:01
45:01
![Земля до начала времён 11: Вторжение Мышезавров (2005) / The Land Before Time XI]()
 1:20:52
1:20:52
![Альфа и Омега 4: Легенда о Зубастой Пещере (2014) / Alpha and Omega 4]()
 45:14
45:14
![Земля до начала времён 2: Приключения в Великой Долине (1994) / The Land Before Time II]()
 1:13:31
1:13:31
![Шерлок Гномс (2018) / Sherlock Gnomes]()
 1:26:19
1:26:19
![Смурфики в кино (2025) / Smurfs]()
 1:29:33
1:29:33
![Дорога домой (2021) / Back to the Outback]()
 1:31:40
1:31:40
![Плохие парни: Очень плохой праздник (2023) / The Bad Guys: A Very Bad Holiday]()
 22:30
22:30
![Девочки из Эквестрии. Легенды вечнозелёного леса (2016) / Equestria Girls. Legend of Everfree]()
 1:13:14
1:13:14
![Альфа и Омега 7: Большое обледенение (2016) / Alpha and Omega 7: The Big Fureeze]()
 45:06
45:06
![Земля до начала времён 3: В поисках воды (1995) / The Land Before Time III]()
 1:10:48
1:10:48
![Земля до начала времён 8: Великая стужа (2001) / The Land Before Time VIII]()
 1:15:49
1:15:49
![Земля до начала времён 5: Таинственный остров (1997) / The Land Before Time V]()
 1:13:30
1:13:30
![Альфа и Омега 5: Семейные каникулы (2014) / Alpha and Omega: Family Vacation]()
 43:30
43:30
![Земля до начала времён 9: Путешествие к Большой Воде (2002) / The Land Before Time IX]()
 1:14:38
1:14:38
![Земля до начала времён 12: Великий День птиц (2006) / The Land Before Time XII]()
 1:20:30
1:20:30

 4:05
4:05Скачать видео
| 256x144 | ||
| 432x232 | ||
| 640x360 | ||
| 856x480 | ||
| 1280x720 | ||
| 1920x1080 |
 3:58
3:58
2025-10-17 11:48
 3:38
3:38
2025-10-11 12:45
 3:20
3:20
2025-10-15 10:27
 3:08
3:08
2025-10-16 11:32
 3:44
3:44
2025-10-21 09:25
 3:05
3:05
2025-10-17 11:37
 3:08
3:08
2025-10-18 10:28
 2:57
2:57
2025-10-15 10:54
 4:10
4:10
2025-10-13 12:31
 4:58
4:58
2025-10-18 10:31
 2:24
2:24
2025-10-14 12:10
 3:27
3:27
2025-10-16 11:15
 4:38
4:38
2025-10-11 12:52
 3:36
3:36
2025-10-18 10:11
 2:57
2:57
2025-10-11 12:26
 4:44
4:44
2025-10-19 10:46
 4:00
4:00
2025-10-18 17:45
 3:46
3:46
2025-10-14 11:30
 3:36
3:36
2025-10-12 18:00
 3:45
3:45
2025-10-15 10:45
0/0
 2:00:03
2:00:03
2025-07-19 19:23
 2:13:21
2:13:21
2025-09-09 12:49
 1:47:26
1:47:26
2025-08-02 13:33
 1:44:37
1:44:37
2025-08-03 10:47
 1:54:10
1:54:10
2025-06-20 15:43
 2:35:53
2:35:53
2025-08-26 11:45
 2:05:22
2:05:22
2025-05-30 00:57
 1:30:05
1:30:05
2025-06-16 20:00
 1:33:34
1:33:34
2025-10-08 12:27
 1:38:22
1:38:22
2025-10-01 12:16
 2:19:54
2:19:54
2025-05-12 21:51
 1:35:11
1:35:11
2025-10-13 12:06
 1:43:53
1:43:53
2025-07-16 20:59
 2:00:30
2:00:30
2025-01-18 21:22
 1:31:20
1:31:20
2025-06-25 14:54
 2:09:55
2:09:55
2025-10-05 00:32
 1:50:21
1:50:21
2025-01-23 19:58
 2:13:53
2:13:53
2025-08-09 11:00
 2:15:54
2:15:54
2025-10-13 19:02
 2:08:34
2:08:34
2025-03-21 19:58
0/0

 45:00
45:00
2025-10-07 18:00

 1:24:21
1:24:21
2025-09-30 18:00

 1:43:47
1:43:47
2025-09-23 18:00

 1:37:06
1:37:06
2025-10-05 18:00

 45:01
45:01
2025-10-10 18:00

 1:20:52
1:20:52
2025-10-02 18:00

 45:14
45:14
2025-10-12 18:00

 1:13:31
1:13:31
2025-09-13 18:00

 1:26:19
1:26:19
2025-09-25 18:00

 1:29:33
1:29:33
2025-09-29 18:00

 1:31:40
1:31:40
2025-09-12 18:00

 22:30
22:30
2025-09-19 18:00

 1:13:14
1:13:14
2025-10-01 18:00

 45:06
45:06
2025-10-18 18:00

 1:10:48
1:10:48
2025-09-15 18:00

 1:15:49
1:15:49
2025-09-26 18:00

 1:13:30
1:13:30
2025-09-20 18:00

 43:30
43:30
2025-10-14 18:00

 1:14:38
1:14:38
2025-09-28 18:00

 1:20:30
1:20:30
2025-10-04 18:00
0/0

