
 4:20
4:20
2025-02-14 13:15

 4:18
4:18

 4:18
4:18
2024-10-30 21:00

 15:43
15:43

 15:43
15:43
2024-09-17 15:58

 8:35
8:35

 8:35
8:35
2023-09-11 02:47

 2:50
2:50

 2:50
2:50
2025-02-23 16:15
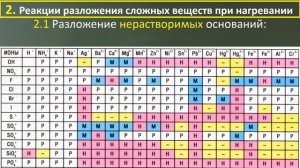
 8:51
8:51

 8:51
8:51
2023-09-10 15:30

 8:28
8:28

 8:28
8:28
2023-10-15 11:37

 6:17
6:17

 6:17
6:17
Химия 8 класс (Урок№14 - Вода в природе и способы её очистки.Физические и химические свойства воды.)
2025-02-23 16:00

 5:23
5:23

 5:23
5:23
2023-12-17 08:19
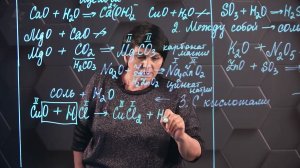
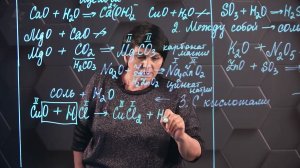 15:51
15:51
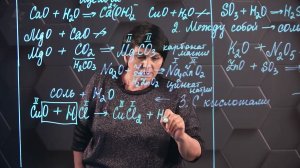
 15:51
15:51
2022-10-11 07:05

 11:54
11:54

 11:54
11:54
2025-11-03 21:49

 38:30
38:30

 38:30
38:30
2024-08-07 09:06

 3:40
3:40

 3:40
3:40
2024-04-24 19:25

 24:30
24:30

 24:30
24:30
2023-11-02 22:58

 1:54:20
1:54:20

 1:54:20
1:54:20
2026-03-08 21:00

 10:11:37
10:11:37

 10:11:37
10:11:37
2025-04-07 07:03

 2:31:42
2:31:42

 2:31:42
2:31:42
2024-12-27 18:26

 1:22:04
1:22:04
![Артур Пирожков - Похудеем позже (Премьера клипа 2026)]() 2:53
2:53
![Шамиль Каримов - Танцуй малая (Премьера клипа 2026)]() 3:33
3:33
![С 8 Марта, милые, красивые женщины]() 5:01
5:01
![Игорь Кибирев - Разведённые мосты (Премьера клипа 2026)]() 3:22
3:22
![Cvetocek7 - Проблема (Премьера клипа 2026)]() 2:29
2:29
![10AGE & Анет Сай - Пропадает (Премьера клипа 2026)]() 2:41
2:41
![Рустам Нахушев - Ландыши (Премьера клипа 2026)]() 4:08
4:08
![Рустам Батербиев - Пушка (Премьера 2026)]() 3:08
3:08
![DAASHA - Сердце на полку (Премьера клипа 2026)]() 2:13
2:13
![С 8 марта девочки мои]() 3:07
3:07
![Женя Белоусова - Ты мой (Премьера клипа 2026)]() 3:33
3:33
![Ислам Мальсуйгенов, Зульфия Чотчаева - Дарман (Премьера клипа 2026)]() 3:01
3:01
![Аюбхон Усмонов - Асал (Премьера клипа 2026)]() 3:28
3:28
![Liana Lee - Глаза-магнит (Премьера клипа 2026)]() 2:01
2:01
![Voydod group - Dilbarijon biyo (Official Video 2026)]() 2:49
2:49
![Айна Гетегазова - Царь зверей (Премьера клипа 2026)]() 3:44
3:44
![Фати Царикаева - Ревность (Премьера клипа 2026)]() 3:27
3:27
![Ахрор Гуломов - Телба (Премьера клипа 2026)]() 5:08
5:08
![Максим АРШАВИН - Горько (Премьера клипа 2026)]() 3:09
3:09
![Вика Ветер - Ты не забывай меня (Премьера клипа 2026)]() 3:57
3:57
![Безымянная романтическая история о вторжении в дом | Untitled Home Invasion Romance (2025)]() 1:25:48
1:25:48
![Обитель зла 4: Жизнь после смерти | Resident Evil: Afterlife (2010)]() 1:37:36
1:37:36
![Лило и Стич | Lilo & Stitch (2025)]() 1:49:28
1:49:28
![Грандиозная подделка | Il falsario (2025)]() 1:55:41
1:55:41
![Давид | David (2025)]() 1:49:18
1:49:18
![Лакомый кусок | The Rip (2025)]() 1:52:50
1:52:50
![Утёс | The Bluff (2026)]() 1:43:46
1:43:46
![Обитель зла: Последняя глава | Resident Evil: The Final Chapter (2016)]() 1:46:38
1:46:38
![Дикий робот | The Wild Robot (2024)]() 1:41:50
1:41:50
![Казнить нельзя помиловать | Mercy (2026)]() 1:43:47
1:43:47
![Тепло наших тел | Warm Bodies (2013)]() 1:37:49
1:37:49
![Новокаин | Novocaine (2025)]() 1:49:34
1:49:34
![Хамнет: История, вдохновившая «Гамлета» | Hamnet (2025)]() 2:05:47
2:05:47
![Точка замерзания | Dead of Winter (2025)]() 1:37:45
1:37:45
![Одинокие волки | Wolfs (2024)]() 1:47:12
1:47:12
![Зомби по имени Шон | Shaun of the Dead (2004)]() 1:39:31
1:39:31
![Иерархия | Hierarchy (2025)]() 1:39:35
1:39:35
![Крипер | Keeper (2025)]() 1:38:41
1:38:41
![Обитель зла 3 | Resident Evil: Extinction (2010)]() 1:34:09
1:34:09
![Дом у дороги | Road House (2024)]() 2:03:29
2:03:29
![Сборники «Ну, погоди!»]() 1:10:01
1:10:01
![Папа Супергерой Сезон 1]() 4:28
4:28
![Мультфильмы военных лет | Специальный проект к 80-летию Победы]() 7:20
7:20
![Корги по имени Моко. Новый питомец]() 3:28
3:28
![Поймай Тинипин! Королевство эмоций]() 12:24
12:24
![Рэй и пожарный патруль Сезон 1]() 13:27
13:27
![Зомби Дамб]() 5:14
5:14
![Пакман в мире привидений]() 21:37
21:37
![Тёплая анимация | Новая авторская анимация Союзмультфильма]() 10:46
10:46
![Мартышкины]() 7:10
7:10
![Лудлвилль]() 7:05
7:05
![Сборники «Умка»]() 1:11:53
1:11:53
![Паровозик Титипо]() 13:42
13:42
![Зебра в клеточку]() 6:30
6:30
![Пип и Альба. Приключения в Соленой Бухте! Сезон 1]() 11:02
11:02
![Супер Дино]() 12:41
12:41
![Истории Баданаму Сезон 1]() 10:02
10:02
![Кадеты Баданаму Сезон 1]() 11:50
11:50
![Последний книжный магазин]() 11:20
11:20
![МиниФорс]() 0:00
0:00
![Сборник Новогодних Номеров 2024 - Уральские Пельмени]() 3:18:51
3:18:51
![Винни-Пух. 1969 год.]() 41:23
41:23
![Зверополис | Zootopia (2016)]() 1:48:48
1:48:48
![Свои. Баллада о войне [2025, драма, военный]]() 1:29:27
1:29:27
![Лучшие в Аду (2022)]() 1:49:08
1:49:08
![Маша и Медведь. Серия 1. Первая встреча]() 6:36
6:36
![Форсаж 9 | F9 (2021)]() 2:22:56
2:22:56
![Сборник Синий Трактор]() 57:36
57:36
![Лева Грузовичок все серии]() 43:59
43:59
![Максим ФАДЕЕВ feat. Григорий ЛЕПС - Орлы или вороны ft.и]() 4:38
4:38
![Сборник Топ 20 Номеров за 2024 год - Уральские Пельмени]() 2:52:30
2:52:30
![Премьера: Предательство - фильм Андрея Медведева от 01.02.2026]() 59:17
59:17
![Форсаж 6 | Furious 6 (2013)]() 2:11:07
2:11:07
![КЛИПЫ 80-90 х - ЗОЛОТЫЕ ХИТЫ - ЛЮБИМЫЕ ПЕСНИ]() 2:07:05
2:07:05
![Инна Вальтер - Дымом лечилась (Исповедь хулиганки)]() 7:04
7:04
![28 лет спустя: Часть II. Храм костей | 28 Years Later: The Bone Temple (2026)]() 1:49:24
1:49:24
![КАМИН 4К 🔥 FIREPLACE 4K | Звуки камина и Треск огня]() 2:00:00
2:00:00
![Три Кота 🐱 Сборник серий подряд | Смотреть онлайн развивающие мультики и игры для детей и малышей]() 3:16:51
3:16:51
![Хищник: Планета смерти | Predator: Badlands (2025)]() 1:47:25
1:47:25
![Сборник Новогодняя Десятка - Уральские Пельмени]() 1:19:08
1:19:08

 1:22:04
1:22:04Скачать Видео с Рутуба / RuTube
| 256x144 | ||
| 424x240 | ||
| 640x360 | ||
| 848x480 | ||
| 1280x720 | ||
| 1920x1080 |
 2:53
2:53
2026-02-28 20:01
 3:33
3:33
2026-02-19 13:20
 5:01
5:01
2026-03-08 09:55
 3:22
3:22
2026-02-25 09:55
 2:29
2:29
2026-03-03 12:53
 2:41
2:41
2026-02-28 19:53
 4:08
4:08
2026-02-26 15:33
 3:08
3:08
2026-02-26 10:16
 2:13
2:13
2026-02-20 09:55
 3:07
3:07
2026-03-08 12:10
 3:33
3:33
2026-02-20 09:27
 3:01
3:01
2026-02-20 19:56
 3:28
3:28
2026-02-25 09:33
 2:01
2:01
2026-02-19 13:26
 2:49
2:49
2026-02-19 13:17
 3:44
3:44
2026-03-04 10:27
 3:27
3:27
2026-03-11 11:23
 5:08
5:08
2026-03-05 09:07
 3:09
3:09
2026-02-20 23:46
 3:57
3:57
2026-02-20 09:52
0/0
 1:25:48
1:25:48
2026-02-26 14:41
 1:37:36
1:37:36
2026-02-25 19:41
 1:49:28
1:49:28
2026-01-23 18:44
 1:55:41
1:55:41
2026-02-26 14:41
 1:49:18
1:49:18
2026-01-29 11:25
 1:52:50
1:52:50
2026-02-04 10:11
 1:43:46
1:43:46
2026-03-03 00:20
 1:46:38
1:46:38
2026-02-25 19:41
 1:41:50
1:41:50
2026-01-23 18:44
 1:43:47
1:43:47
2026-02-23 10:58
 1:37:49
1:37:49
2026-02-16 08:53
 1:49:34
1:49:34
2026-01-23 18:44
 2:05:47
2:05:47
2026-02-06 18:40
 1:37:45
1:37:45
2026-01-26 14:35
 1:47:12
1:47:12
2026-01-23 18:43
 1:39:31
1:39:31
2026-02-16 01:07
 1:39:35
1:39:35
2026-02-06 18:40
 1:38:41
1:38:41
2026-03-06 19:13
 1:34:09
1:34:09
2026-02-25 19:41
 2:03:29
2:03:29
2026-01-23 18:43
0/0
 1:10:01
1:10:01
2025-07-25 20:16
2021-09-22 21:52
 7:20
7:20
2025-05-03 12:34
 3:28
3:28
2025-01-09 17:01
 12:24
12:24
2024-11-27 13:24
2021-09-22 23:51
 5:14
5:14
2024-11-28 13:12
 21:37
21:37
2024-11-28 17:35
 10:46
10:46
2022-06-07 11:02
 7:10
7:10
2025-12-30 18:33
 7:05
7:05
2025-12-30 20:49
 1:11:53
1:11:53
2026-01-29 11:37
 13:42
13:42
2024-11-28 14:12
 6:30
6:30
2022-03-31 13:09
2021-09-22 23:36
 12:41
12:41
2024-11-28 12:54
2021-09-22 21:29
2021-09-22 21:17
 11:20
11:20
2025-09-12 10:05
 0:00
0:00
2026-03-11 18:16
0/0
Скачать популярное видео
Популярное видео
2024-12-31 14:00
2023-11-19 12:01
 1:48:48
1:48:48
2024-12-16 19:01
2025-04-11 14:51
2022-10-20 11:01
2015-02-06 15:18
 2:22:56
2:22:56
2023-04-25 23:06
2024-11-13 13:06
2022-09-16 07:26
 4:38
4:38
2017-12-19 08:20
2025-01-13 14:00
 59:17
59:17
2026-02-01 14:02
 2:11:07
2:11:07
2023-04-25 22:52
2023-05-31 14:59
 7:04
7:04
2018-07-11 11:26
 1:49:24
1:49:24
2026-02-19 14:08
2024-12-19 00:00
 3:16:51
3:16:51
2025-10-03 19:48
 1:47:25
1:47:25
2025-11-27 03:58
2026-01-01 13:59
0/0

