
 6:13
6:13
2024-10-30 18:30

 7:30
7:30

 7:30
7:30
2025-02-25 11:00

 17:45
17:45

 17:45
17:45
2023-12-06 18:14

 39:02
39:02

 39:02
39:02
2025-05-20 13:55

 7:53
7:53

 7:53
7:53
2023-12-06 19:19

 8:21
8:21

 8:21
8:21
2023-12-17 05:23

 6:02
6:02

 6:02
6:02
2025-03-05 01:47

 12:21
12:21

 12:21
12:21
2024-03-14 10:47

 3:28
3:28

 3:28
3:28
2023-12-28 05:37

 3:33
3:33

 3:33
3:33
2024-02-10 18:53
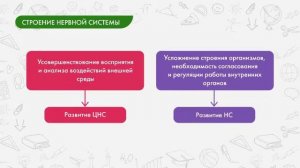
 10:14
10:14

 10:14
10:14
2023-11-09 19:16

 25:35
25:35

 25:35
25:35
2022-08-20 22:27

 4:15
4:15

 4:15
4:15
2023-02-01 16:10
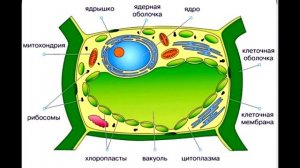
 8:39
8:39

 8:39
8:39
2023-09-05 10:11
 7:12
7:12

 7:12
7:12
2023-09-11 12:30
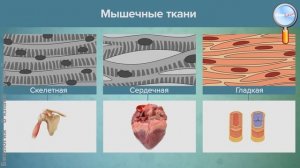
 4:56
4:56

 4:56
4:56
2023-09-09 14:19

 21:08
21:08

 21:08
21:08
2023-06-28 10:50
 10:36
10:36
![Премьера клипа! 55x55 – СВЭГ (feat. Ксения Собчак)]() 1:42
1:42
![Премьера клипа! NEMIGA, NAVAI - Пойдем в кино]() 2:47
2:47
![Премьера клипа! ХАБИБ - Шаганэ]() 2:49
2:49
![Премьера клипа! DJ SMASH, D’Or – РОЗОВЫЙ ТУМАН]() 3:05
3:05
![Премьера клипа! Мари aka Краймбрери — Интеллект]() 2:32
2:32
![Премьера клипа! Инна Вальтер - С козырей зашёл]() 3:31
3:31
![Премьера клипа! Мари Краймбрери – Сегодня мой лучший день]() 3:10
3:10
![Премьера клипа! BEARWOLF - Ястребы (OST «Этерна»)]() 2:26
2:26
![Премьера клипа! Лизогуб и Amirchik - Неуловимая]() 2:26
2:26
![Премьера Клипа! Егор Крид и Григорий Лепс - Пепел (OST "Вниз")]() 3:15
3:15
![Премьера! Джиган и NILETTO ft. Loc-Dog - Дорого (LIVE)]() 2:37
2:37
![Премьера клипа! AY YOLA - Ugez]() 3:53
3:53
![Премьера клипа! Артур Пирожков и Элвин Грей - Женщина-Магнит]() 3:13
3:13
![Премьера клипа! Моя Мишель - Иногда]() 3:12
3:12
![Премьера клипа! ПАРОДА - Скажешь мне да]() 3:38
3:38
![ROSÉ & PSY - APT.]() 3:00
3:00
![Премьера клипа! Kamazz и Валерия feat. Red Square - Зеркала]() 3:00
3:00
![Премьера клипа! Люся Чеботина - Каблук]() 3:15
3:15
![Премьера! 3-ий Январь и IL'GIZ - Дорога дальняя]() 2:44
2:44
![Премьера клипа! Егор Крид - Одиноко]() 2:16
2:16
![Рыжая Соня (2025)]() 1:50:40
1:50:40
![Последний клиент]() 1:33:23
1:33:23
![Убийца по имени Неро (мини–сериал) (2025)]() 6:59:56
6:59:56
![Макс Пэйн (2008) (Расширенная версия)]() 1:42:59
1:42:59
![Школьный автобус | The Lost Bus (2025)]() 2:09:55
2:09:55
![Девушка из каюты №10 (2025)]() 1:35:13
1:35:13
![Добыча (2022)]() 1:45:08
1:45:08
![Некая справедливость (2014)]() 1:32:52
1:32:52
![Легенды: Гробница дракона (2013)]() 1:32:30
1:32:30
![Алиса в Стране чудес: Все части 1, 2 (фильмы)]() 4:14:09
4:14:09
![Терминатор | The Terminator (1984) (Гоблин)]() 1:47:17
1:47:17
![Кровь искупления (2013) 1080]() 1:25:11
1:25:11
![Скелеты Железного острова]() 1:25:19
1:25:19
![Первый день моей жизни]() 1:56:45
1:56:45
![Плохой Cанта 2 | Bad Santa 2 (2016) (Гоблин)]() 1:28:32
1:28:32
![101 далматинец (фильм, 1996) | Круэлла и далматинцы]() 2:12:42
2:12:42
![Порочный круг (2025)]() 1:43:41
1:43:41
![Токсичный мститель (2023)]() 1:42:11
1:42:11
![Чумовая пятница (2003)]() 1:36:57
1:36:57
![История моей жены]() 2:42:50
2:42:50
![Приключения Десперо (2008) / The Tale of Despereaux]()
 1:33:38
1:33:38
![Барби: Скиппер и большое приключение с детьми (2023) / Skipper and the Big Babysitting Adventure]()
 1:02:58
1:02:58
![Земля до начала времён 4: Путешествие в Землю Туманов (1996) / The Land Before Time IV]()
 1:13:52
1:13:52
![Земля до начала времён 13: Сила дружбы (2007) / The Land Before Time XIII]()
 1:15:39
1:15:39
![Иллюзионист (2010) / L'illusionniste]()
 1:19:53
1:19:53
![Дорога домой (2021) / Back to the Outback]()
 1:31:40
1:31:40
![Упс… Ной уплыл! (2015) / Ooops! Noah Is Gone...]()
 1:26:28
1:26:28
![Альфа и Омега 6: Прогулка с динозавром (2015) / Alpha and Omega: Dino Digs]()
 47:29
47:29
![Науэль и волшебная книга (2020) / Nauel and the Magic Book]()
 1:37:06
1:37:06
![Девочки из Эквестрии. Легенды вечнозелёного леса (2016) / Equestria Girls. Legend of Everfree]()
 1:13:14
1:13:14
![Земля до начала времён 11: Вторжение Мышезавров (2005) / The Land Before Time XI]()
 1:20:52
1:20:52
![Альфа и Омега 2: Приключения праздничного воя (2013) / Alpha and Omega 2: A Howl-iday Adventure]()
 45:08
45:08
![Земля до начала времён 10: Великая миграция (2003) / The Land Before Time X]()
 1:24:21
1:24:21
![Плохие парни: Жутковатое ограбление (2024) / The Bad Guys: Haunted Heist]()
 22:03
22:03
![Земля до начала времён 7: Камень Холодного Огня (2000) / The Land Before Time VII]()
 1:14:10
1:14:10
![Земля до начала времён 12: Великий День птиц (2006) / The Land Before Time XII]()
 1:20:30
1:20:30
![Эти прекрасные мультяшки: Рождественский выпуск (1992) / It's a Wonderful Christmas Special]()
 22:22
22:22
![Земля до начала времён 9: Путешествие к Большой Воде (2002) / The Land Before Time IX]()
 1:14:38
1:14:38
![Альфа и Омега 3: Большие Волчьи Игры (2013) / Alpha and Omega 3: The Great Wolf Games]()
 45:01
45:01
![Земля до начала времён 2: Приключения в Великой Долине (1994) / The Land Before Time II]()
 1:13:31
1:13:31

 10:36
10:36Скачать видео
| 256x144 | ||
| 432x232 | ||
| 640x360 | ||
| 856x480 | ||
| 1280x720 | ||
| 1920x1080 |
2025-09-28 15:10
 2:47
2:47
2025-10-10 09:59
 2:49
2:49
2025-10-10 09:59
 3:05
3:05
2025-08-15 12:09
 2:32
2:32
2025-08-14 17:53
2025-09-30 09:56
 3:10
3:10
2025-09-26 10:45
 2:26
2:26
2025-08-21 09:28
 2:26
2:26
2025-08-05 17:07
 3:15
3:15
2025-08-29 15:48
 2:37
2:37
2025-09-17 08:58
 3:53
3:53
2025-09-06 15:26
 3:13
3:13
2025-09-19 18:07
2025-10-08 20:01
 3:38
3:38
2025-09-02 10:34
 3:00
3:00
2025-08-25 16:32
 3:00
3:00
2025-09-12 13:18
 3:15
3:15
2025-09-17 21:08
 2:44
2:44
2025-08-26 15:20
 2:16
2:16
2025-08-25 16:04
0/0
 1:50:40
1:50:40
2025-10-15 14:11
 1:33:23
1:33:23
2025-10-13 11:36
 6:59:56
6:59:56
2025-10-14 16:25
 1:42:59
1:42:59
2025-10-15 16:40
 2:09:55
2:09:55
2025-10-05 00:32
 1:35:13
1:35:13
2025-10-12 11:54
 1:45:08
1:45:08
2025-10-06 12:51
2025-10-13 04:45
2025-10-10 08:28
 4:14:09
4:14:09
2025-10-06 16:06
 1:47:17
1:47:17
2025-10-07 09:28
2025-10-08 15:51
 1:25:19
1:25:19
2025-10-13 11:18
 1:56:45
1:56:45
2025-10-13 11:38
 1:28:32
1:28:32
2025-10-07 09:27
 2:12:42
2:12:42
2025-10-14 17:28
 1:43:41
1:43:41
2025-10-13 12:39
 1:42:11
1:42:11
2025-10-14 21:50
 1:36:57
1:36:57
2025-10-05 17:21
 2:42:50
2:42:50
2025-10-13 11:40
0/0

 1:33:38
1:33:38
2025-10-09 18:00

 1:02:58
1:02:58
2025-09-07 18:00

 1:13:52
1:13:52
2025-09-17 18:00

 1:15:39
1:15:39
2025-10-06 18:00

 1:19:53
1:19:53
2025-10-11 18:00

 1:31:40
1:31:40
2025-09-12 18:00

 1:26:28
1:26:28
2025-09-06 18:00

 47:29
47:29
2025-10-16 18:02

 1:37:06
1:37:06
2025-10-05 18:00

 1:13:14
1:13:14
2025-10-01 18:00

 1:20:52
1:20:52
2025-10-02 18:00

 45:08
45:08
2025-10-08 18:00

 1:24:21
1:24:21
2025-09-30 18:00

 22:03
22:03
2025-09-21 18:00

 1:14:10
1:14:10
2025-09-24 18:00

 1:20:30
1:20:30
2025-10-04 18:00

 22:22
22:22
2025-09-11 18:00

 1:14:38
1:14:38
2025-09-28 18:00

 45:01
45:01
2025-10-10 18:00

 1:13:31
1:13:31
2025-09-13 18:00
0/0

