
 14:42
14:42
2025-02-07 18:15
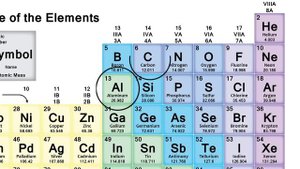
 13:55
13:55

 13:55
13:55
2023-09-24 09:51
 8:19
8:19
 8:19
8:19
2023-09-26 19:05

 7:22
7:22

 7:22
7:22
2023-09-30 02:37

 12:53
12:53

 12:53
12:53
2023-04-25 15:07

 9:49
9:49

 9:49
9:49
2025-02-18 21:01

 4:46
4:46

 4:46
4:46
2024-09-25 20:00
 4:17
4:17
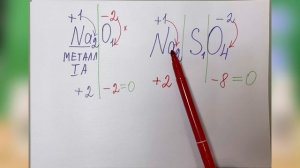 4:17
4:17
2024-09-30 16:01

 18:30
18:30

 18:30
18:30
2023-08-26 13:26

 15:25
15:25

 15:25
15:25
2025-05-13 12:00

 1:32:36
1:32:36

 1:32:36
1:32:36
2026-01-22 08:00

 2:58:11
2:58:11

 2:58:11
2:58:11
2023-09-20 15:09

 11:16:29
11:16:29

 11:16:29
11:16:29
2025-05-23 08:04

 3:12:39
3:12:39

 3:12:39
3:12:39
2023-09-15 21:20

 5:36
5:36

 5:36
5:36
2026-01-15 01:44

 3:48:10
3:48:10

 3:48:10
3:48:10
2023-09-18 01:16

 2:32:19
2:32:19

 2:32:19
2:32:19
2023-09-10 18:25

 2:40:56
2:40:56
![Арина Войт - Смелая (Премьера клипа 2026)]() 2:52
2:52
![DJ Serzh - Она играла лишь со мной (Премьера клипа 2026)]() 4:12
4:12
![Рада Рай - Мечта (Премьера клипа 2025)]() 4:43
4:43
![Евгений Путилов - Леди ночь (Премьера клипа 2025)]() 3:33
3:33
![Соня Белькевич, ATLANA - Поверь (Премьера 2025)]() 3:59
3:59
![Амина Магомедова - Танцуй со мной (Премьера клипа 2026)]() 3:08
3:08
![Низомчон Азимов - Меравам (Премьера клипа 2026)]() 2:42
2:42
![NAIMAN - Твои глаза (Премьера клипа 2025)]() 2:49
2:49
![Кравц - 99 проблем (Премьера клипа 2026)]() 2:30
2:30
![Артур Бесаев - Там где горы (Премьера клипа 2026)]() 2:15
2:15
![Дана Лахова - Ай, яй, яй (Премьера клипа 2026)]() 2:53
2:53
![Karen ТУЗ, Gaya Khan – Sirum Em Qez (Премьера 2025)]() 3:22
3:22
![Гунеша - Юр кетамиз (Премьера клипа 2026)]() 3:13
3:13
![Рустам Батербиев - Стерва-ночь (Премьера клипа 2026)]() 2:24
2:24
![DJ Serzh - Мелочи (Премьера клипа 2026)]() 3:22
3:22
![Cvetocek7 - Молния (Премьера клипа 2026)]() 2:41
2:41
![Виктор Королёв - А ты яблоко ела (Премьера 2026)]() 3:44
3:44
![Григорий Герасимов - Я другой (Премьера клипа 2026)]() 3:32
3:32
![AY YOLA, ALSOU - Ay, bylbylym (Премьера клипа 2026)]() 4:08
4:08
![Вусал Мирзаев - Ты моя (Премьера клипа 2026)]() 2:14
2:14
![Сожалею о тебе | Regretting You (2025)]() 1:55:53
1:55:53
![Джей Келли | Jay Kelly (2025)]() 2:13:54
2:13:54
![Баллада о маленьком игроке | Ballad of a Small Player (2025)]() 1:42:60
1:42:60
![Безжалостная | Stone Cold Fox (2025)]() 1:25:31
1:25:31
![Рука, качающая колыбель | The Hand That Rocks the Cradle (2025)]() 1:44:57
1:44:57
![Семейный план 2 | The Family Plan 2 (2025)]() 1:46:14
1:46:14
![Гарри Поттер и Принц-полукровка | Harry Potter and the Half-Blood Prince (2009)]() 2:33:36
2:33:36
![После охоты | After the Hunt (2025)]() 2:20:25
2:20:25
![Злая. Часть 2 | Wicked: For Good (2025)]() 2:17:37
2:17:37
![Отпуск на двоих | People We Meet on Vacation (2026)]() 1:57:55
1:57:55
![Трон: Арес | Tron: Ares (2025)]() 1:52:27
1:52:27
![Гарри Поттер и Орден Феникса | Harry Potter and the Order of the Phoenix (2007)]() 2:18:19
2:18:19
![Мерв | Merv (2025)]() 1:46:56
1:46:56
![Игры Биста. 2 сезон, 3 серия | Beast Games 2 season]() 57:01
57:01
![Один дома | Home Alone (1990)]() 1:43:02
1:43:02
![Всемирный потоп | Daehongsu (2025)]() 1:48:57
1:48:57
![Один дома 2: Затерянный в Нью-Йорке | Home Alone 2: Lost in New York (1992)]() 2:00:06
2:00:06
![Франкенштейн | Frankenstein (2025)]() 2:32:29
2:32:29
![Гедда | Hedda (2025)]() 1:48:23
1:48:23
![Ловчий смерти | Deathstalker (2025)]() 1:42:60
1:42:60
![Агент 203]() 21:08
21:08
![Последний книжный магазин]() 11:20
11:20
![Тодли Великолепный!]() 3:15
3:15
![Простоквашино]() 6:44
6:44
![Простоквашино. Финансовая грамотность]() 3:27
3:27
![Крутиксы]() 11:00
11:00
![Поймай Тинипин! Королевство эмоций]() 12:24
12:24
![Корги по имени Моко. Защитники планеты]() 4:33
4:33
![Неодети]() 11:27
11:27
![Команда Дино Сезон 2]() 12:31
12:31
![Псэмми. Пять детей и волшебство Сезон 1]() 12:17
12:17
![Приключения Пети и Волка]() 11:00
11:00
![Отряд А. Игрушки-спасатели]() 13:06
13:06
![Зомби Дамб]() 5:14
5:14
![Ну, погоди! Каникулы]() 7:04
7:04
![Паровозик Титипо]() 13:42
13:42
![Пингвиненок Пороро]() 7:42
7:42
![Мультфильмы военных лет | Специальный проект к 80-летию Победы]() 7:20
7:20
![Панда и Антилопа]() 12:08
12:08
![Полли Покет Сезон 1]() 21:30
21:30

 2:40:56
2:40:56Скачать Видео с Рутуба / RuTube
| 256x144 | ||
| 424x240 | ||
| 640x360 | ||
| 856x480 | ||
| 1280x720 | ||
| 1920x1080 |
 2:52
2:52
2026-01-08 12:25
 4:12
4:12
2026-01-12 10:16
 4:43
4:43
2025-12-30 11:35
 3:33
3:33
2025-12-26 14:14
 3:59
3:59
2025-12-28 13:25
 3:08
3:08
2026-01-15 13:41
 2:42
2:42
2026-01-04 11:59
 2:49
2:49
2025-12-26 13:54
 2:30
2:30
2026-01-14 15:04
 2:15
2:15
2026-01-16 16:50
 2:53
2:53
2026-01-22 11:17
 3:22
3:22
2025-12-26 14:52
 3:13
3:13
2026-01-12 10:24
 2:24
2:24
2026-01-15 13:21
 3:22
3:22
2026-01-05 10:03
 2:41
2:41
2026-01-16 16:41
 3:44
3:44
2026-01-08 12:44
 3:32
3:32
2026-01-14 15:22
 4:08
4:08
2026-01-07 22:29
 2:14
2:14
2026-01-15 12:40
0/0
 1:55:53
1:55:53
2025-12-17 23:52
 2:13:54
2:13:54
2025-12-08 13:26
 1:42:60
1:42:60
2025-10-31 10:53
 1:25:31
1:25:31
2025-11-10 21:11
 1:44:57
1:44:57
2025-10-29 16:30
 1:46:14
1:46:14
2025-11-26 06:44
 2:33:36
2:33:36
2025-12-25 15:40
 2:20:25
2:20:25
2025-11-27 19:24
 2:17:37
2:17:37
2026-01-14 15:48
 1:57:55
1:57:55
2026-01-14 15:48
 1:52:27
1:52:27
2025-11-06 18:12
 2:18:19
2:18:19
2025-12-25 15:40
 1:46:56
1:46:56
2025-12-12 13:56
 57:01
57:01
2026-01-07 23:55
 1:43:02
1:43:02
2025-12-25 15:40
 1:48:57
1:48:57
2026-01-14 15:48
 2:00:06
2:00:06
2025-12-25 15:39
 2:32:29
2:32:29
2025-11-17 11:22
 1:48:23
1:48:23
2025-11-05 19:47
 1:42:60
1:42:60
2025-12-03 17:17
0/0
 21:08
21:08
2025-01-09 16:39
 11:20
11:20
2025-09-12 10:05
 3:15
3:15
2025-06-10 13:56
 6:44
6:44
2026-01-12 16:22
 3:27
3:27
2024-12-07 11:00
 11:00
11:00
2022-07-25 18:59
 12:24
12:24
2024-11-27 13:24
 4:33
4:33
2024-12-17 16:56
 11:27
11:27
2025-10-10 18:25
2021-09-22 22:40
2021-09-22 22:23
 11:00
11:00
2022-04-01 17:59
 13:06
13:06
2024-11-28 16:30
 5:14
5:14
2024-11-28 13:12
 7:04
7:04
2026-01-12 15:05
 13:42
13:42
2024-11-28 14:12
 7:42
7:42
2024-12-17 12:21
 7:20
7:20
2025-05-03 12:34
 12:08
12:08
2025-06-10 14:59
2021-09-22 23:09
0/0

