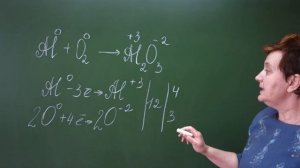
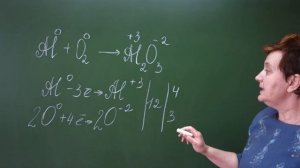 13:14
13:14
2023-09-20 01:03

 18:30
18:30

 18:30
18:30
2023-08-26 13:26
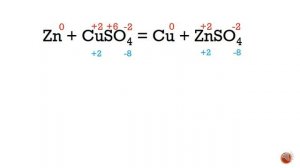
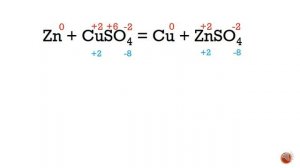 6:28
6:28
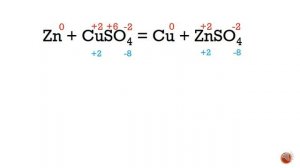
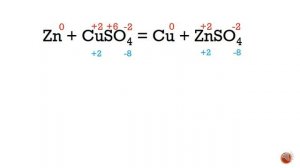 6:28
6:28
2023-12-17 11:34

 6:07
6:07

 6:07
6:07
2025-01-16 03:56

 13:23
13:23

 13:23
13:23
2024-09-19 12:30
 4:31
4:31

 4:31
4:31
2023-12-03 19:03

 8:23
8:23

 8:23
8:23
2025-01-16 03:36

 14:26
14:26

 14:26
14:26
2023-11-26 08:06

 4:18
4:18

 4:18
4:18
2025-02-07 11:40

 12:33
12:33

 12:33
12:33
2024-12-23 07:21

 8:56
8:56

 8:56
8:56
2025-01-18 06:06

 14:03
14:03

 14:03
14:03
2020-12-24 11:31

 1:07:59
1:07:59

 1:07:59
1:07:59
2019-08-29 10:14
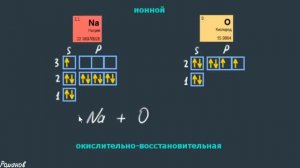
 9:23
9:23

 9:23
9:23
2023-09-03 11:33

 9:15
9:15

 9:15
9:15
2023-09-12 20:59

 5:44
5:44

 5:44
5:44
2023-09-28 15:36

 3:25
3:25

 3:25
3:25
2022-01-03 10:54

 5:50
5:50
![Zhamil Turan - Капали (Премьера клипа 2025)]() 3:08
3:08
![Игорь Кибирев - Пьяная ночь (Премьера клипа 2025)]() 3:08
3:08
![Игорь Крутой - Зонтик (Премьера клипа 2025)]() 4:00
4:00
![MEDNA - Алё (Премьера клипа 2025)]() 2:28
2:28
![Владимир Ждамиров - Чифирок (Премьера клипа 2025)]() 3:49
3:49
![INSTASAMKA - BOSS (Премьера клипа 2025)]() 3:41
3:41
![Алмас Багратиони - Сила веры (Премьера клипа 2025)]() 3:18
3:18
![Рейсан Магомедкеримов, Ренат Омаров - Бла-та-та (Премьера клипа 2025)]() 2:26
2:26
![INSTASAMKA - AGENT GIRL (Премьера клипа 2025)]() 3:24
3:24
![Шерзодбек Жонибеков - Дадажон (Премьера клипа 2025)]() 3:02
3:02
![ИЮЛА - Ты был прав (Премьера клипа 2025)]() 2:21
2:21
![Азиз Абдуллох - Аллохнинг айтгани булади (Премьера клипа 2025)]() 3:40
3:40
![SERYABKINA, Брутто - Светофоры (Премьера клипа 2025)]() 3:49
3:49
![Зара - Я несла свою беду (Премьера клипа 2025)]() 3:36
3:36
![Фаррух Хамраев - Отажоним булсайди (Премьера клипа 2025)]() 3:08
3:08
![Бонухон & Сардорбек Машарипов - Шанс (Премьера клипа 2025)]() 3:28
3:28
![Гор Мартиросян - 101 роза (Премьера клипа 2025)]() 4:26
4:26
![Фати Царикаева - Стамбул (Премьера клипа 2025)]() 2:57
2:57
![Женя Белоусова - Кто тебе сказал (Премьера клипа 2025)]() 3:27
3:27
![МАРАТ & АРНИ - Стала женой (Премьера клипа 2025)]() 3:51
3:51
![Счастливчик Гилмор 2 | Happy Gilmore (2025)]() 1:57:36
1:57:36
![Школьный автобус | The Lost Bus (2025)]() 2:09:55
2:09:55
![Свинтусы | The Twits (2025)]() 1:42:50
1:42:50
![F1 (2025)]() 2:35:53
2:35:53
![Девушка из каюты №10 | The Woman in Cabin 10 (2025)]() 1:35:11
1:35:11
![Богомол | Samagwi (2025)]() 1:53:29
1:53:29
![Свинья | Pig (2021)]() 1:31:23
1:31:23
![Сколько стоит жизнь? | What Is Life Worth (2020)]() 1:58:51
1:58:51
![Пойман с поличным | Caught Stealing (2025)]() 1:46:45
1:46:45
![Стив | Steve (2025)]() 1:33:34
1:33:34
![Супруги Роуз | The Roses (2025)]() 1:45:29
1:45:29
![Сумерки | Twilight (2008)]() 2:01:55
2:01:55
![Большое смелое красивое путешествие | A Big Bold Beautiful Journey (2025)]() 1:49:20
1:49:20
![Тот самый | Him (2025)]() 1:36:20
1:36:20
![Элис, дорогая | Alice, Darling (2022)]() 1:29:30
1:29:30
![Псы войны | Hounds of War (2024)]() 1:34:38
1:34:38
![Мальчишник в Таиланде | Changeland (2019)]() 1:25:47
1:25:47
![Обитель | The Home (2025)]() 1:34:43
1:34:43
![Долгая прогулка | The Long Walk (2025)]() 1:48:08
1:48:08
![Фантастическая четвёрка: Первые шаги | The Fantastic Four: First Steps (2025)]() 1:54:40
1:54:40
![Супер Зак]() 11:38
11:38
![Мартышкины]() 7:09
7:09
![МегаМен: Полный заряд Сезон 1]() 10:42
10:42
![Сборники «Умка»]() 1:20:52
1:20:52
![Люк - путешественник во времени]() 1:19:50
1:19:50
![Мультфильмы военных лет | Специальный проект к 80-летию Победы]() 7:20
7:20
![Приключения Пети и Волка]() 11:00
11:00
![Зебра в клеточку]() 6:30
6:30
![Корги по имени Моко. Домашние животные]() 1:13
1:13
![Пиратская школа]() 11:06
11:06
![Пингвиненок Пороро]() 7:42
7:42
![Таинственные золотые города]() 23:04
23:04
![Мотофайтеры]() 13:10
13:10
![Чуч-Мяуч]() 7:04
7:04
![Роботы-пожарные]() 12:31
12:31
![Школьный автобус Гордон]() 12:34
12:34
![Тодли Великолепный!]() 3:15
3:15
![Зомби Дамб]() 5:14
5:14
![Рэй и пожарный патруль Сезон 1]() 13:27
13:27
![Пластилинки]() 25:31
25:31

 5:50
5:50Скачать видео
| 256x144 | ||
| 424x240 | ||
| 640x360 | ||
| 856x480 | ||
| 1280x720 | ||
| 1920x1080 |
 3:08
3:08
2025-10-22 14:26
 3:08
3:08
2025-10-16 11:32
 4:00
4:00
2025-10-18 10:19
 2:28
2:28
2025-10-21 09:22
 3:49
3:49
2025-10-16 10:37
 3:41
3:41
2025-10-23 13:04
 3:18
3:18
2025-10-24 12:09
 2:26
2:26
2025-10-22 14:10
 3:24
3:24
2025-10-17 11:33
 3:02
3:02
2025-10-25 13:03
 2:21
2:21
2025-10-18 10:16
 3:40
3:40
2025-10-18 10:34
 3:49
3:49
2025-10-25 12:52
 3:36
3:36
2025-10-18 10:07
 3:08
3:08
2025-10-18 10:28
 3:28
3:28
2025-10-24 11:20
 4:26
4:26
2025-10-25 12:55
 2:57
2:57
2025-10-15 10:54
 3:27
3:27
2025-10-16 11:15
 3:51
3:51
2025-10-16 11:41
0/0
 1:57:36
1:57:36
2025-08-21 17:43
 2:09:55
2:09:55
2025-10-05 00:32
 1:42:50
1:42:50
2025-10-21 16:19
 2:35:53
2:35:53
2025-08-26 11:45
 1:35:11
1:35:11
2025-10-13 12:06
 1:53:29
1:53:29
2025-10-01 12:06
 1:31:23
1:31:23
2025-08-27 18:01
 1:58:51
1:58:51
2025-08-27 17:17
 1:46:45
1:46:45
2025-10-02 20:45
 1:33:34
1:33:34
2025-10-08 12:27
 1:45:29
1:45:29
2025-10-23 18:26
 2:01:55
2:01:55
2025-08-28 15:32
 1:49:20
1:49:20
2025-10-21 22:50
 1:36:20
1:36:20
2025-10-09 20:02
 1:29:30
1:29:30
2025-09-11 08:20
 1:34:38
1:34:38
2025-08-28 15:32
 1:25:47
1:25:47
2025-08-27 17:17
 1:34:43
1:34:43
2025-09-09 12:49
 1:48:08
1:48:08
2025-10-24 17:32
 1:54:40
1:54:40
2025-09-24 11:35
0/0
2021-09-22 22:07
 7:09
7:09
2025-04-01 16:06
2021-09-22 21:43
 1:20:52
1:20:52
2025-09-19 17:54
 1:19:50
1:19:50
2024-12-17 16:00
 7:20
7:20
2025-05-03 12:34
 11:00
11:00
2022-04-01 17:59
 6:30
6:30
2022-03-31 13:09
 1:13
1:13
2024-11-29 14:40
 11:06
11:06
2022-04-01 15:56
 7:42
7:42
2024-12-17 12:21
 23:04
23:04
2025-01-09 17:26
 13:10
13:10
2024-11-27 14:57
 7:04
7:04
2022-03-29 15:20
2021-09-23 00:12
 12:34
12:34
2024-12-02 14:42
 3:15
3:15
2025-06-10 13:56
 5:14
5:14
2024-11-28 13:12
2021-09-22 23:51
 25:31
25:31
2022-04-01 14:30
0/0

